Похожие презентации:
Коррозия металлов
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2020
1
2.
Коррозия – разрушение металлови сплавов под воздействием
окружающей среды. Слово
коррозия происходит от
латинского corrodere, что означает
разъедать.
2
3.
Знаменитая Кутубская колонна в Индии близДели уже почти полторы тысячи лет стоит и не
разрушается, несмотря на жаркий и влажный
климат. Сделана она из железа, в котором почти нет
примесей.
Данная
колонна
практически
на 99,8%
изготовлена
из железа в
начале V века.
3
4.
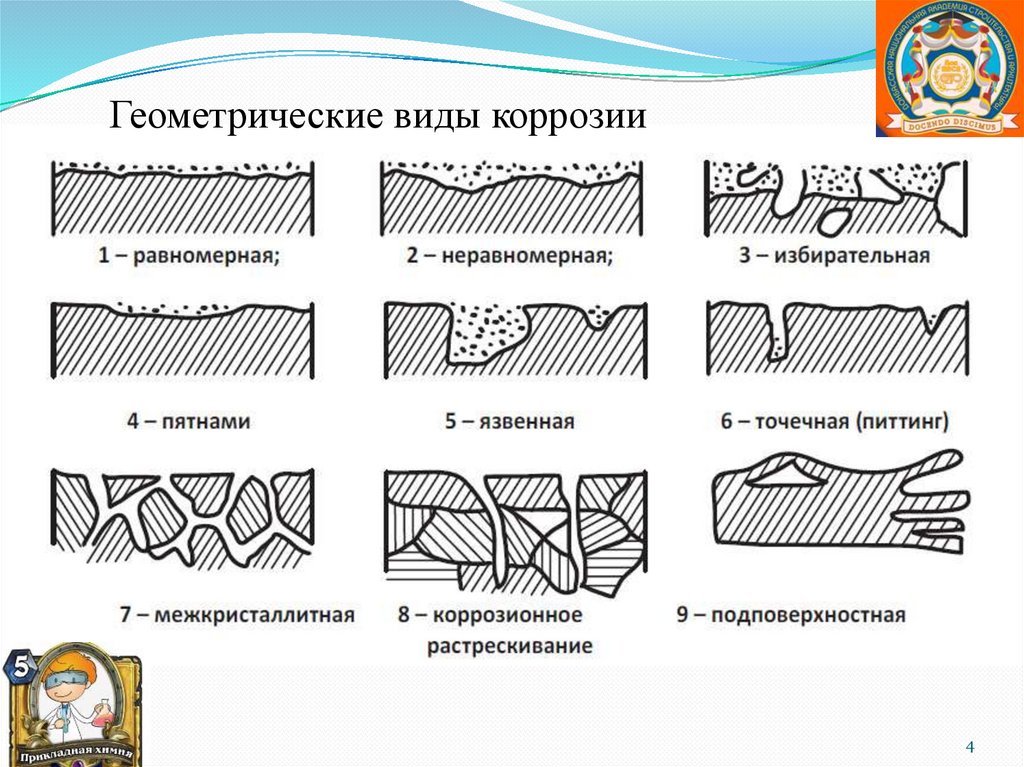
Геометрические виды коррозии4
5.
Химическая коррозияХимическая коррозия –
это взаимодействие
металлов с сухими
газами и жидкостями –
неэлектролитами.
Такому виду коррозии
подвергаются турбины,
арматура печей и детали
двигателей внутреннего
сгорания.
5
6.
Электрохимическаякоррозия
Электрохимическая
коррозия – это все
случаи коррозии в
присутствии воды и
жидкостей –
электролитов.
6
7.
Сущность коррозии.Коррозия состоит из
двух процессов:
химического – это
отдача электронов и
электрического – это
перенос электронов.
7
8.
Закономерности коррозии:1. Если соединены два разных металла, то
коррозии подвергается только более активный, и
пока он полностью не разрушится, менее
активный защищён.
2. Скорость коррозии тем больше, чем дальше друг
от друга в ряду напряжений расположены
соединённые металлы.
8
9.
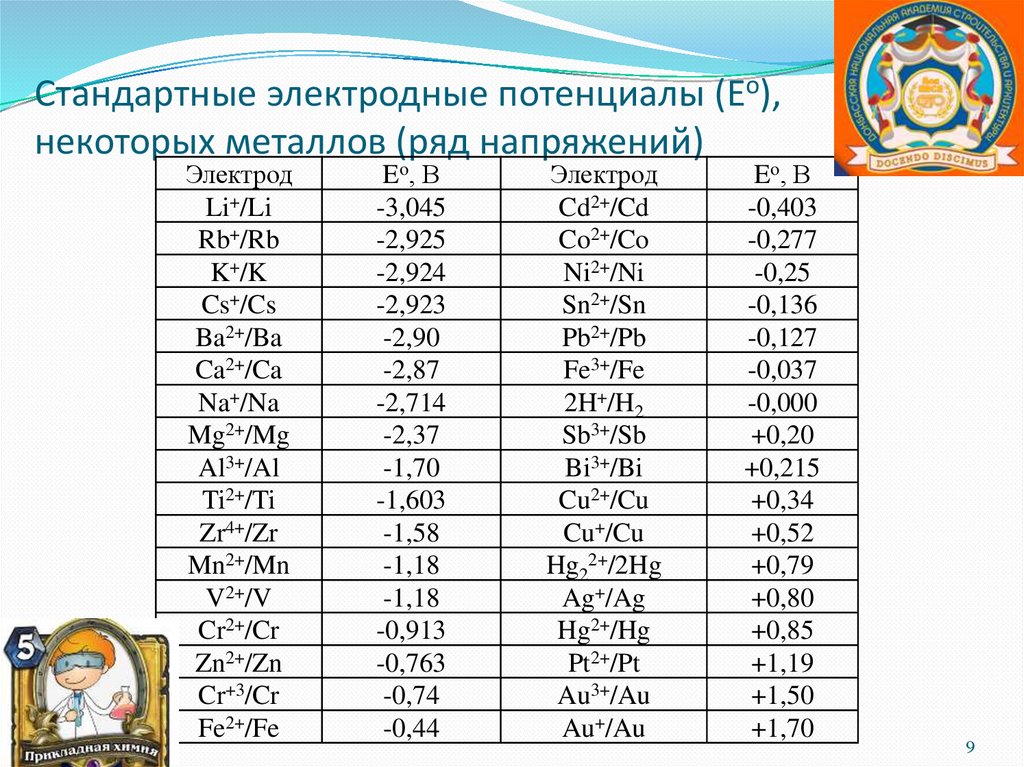
Стандартные электродные потенциалы (Eo),некоторых металлов (ряд напряжений)
Электрод
Li+/Li
Rb+/Rb
K+/K
Cs+/Cs
Ba2+/Ba
Ca2+/Ca
Na+/Na
Mg2+/Mg
Al3+/Al
Ti2+/Ti
Zr4+/Zr
Mn2+/Mn
V2+/V
Cr2+/Cr
Zn2+/Zn
Cr+3/Cr
Fe2+/Fe
Eo, В
-3,045
-2,925
-2,924
-2,923
-2,90
-2,87
-2,714
-2,37
-1,70
-1,603
-1,58
-1,18
-1,18
-0,913
-0,763
-0,74
-0,44
Электрод
Cd2+/Cd
Co2+/Co
Ni2+/Ni
Sn2+/Sn
Pb2+/Pb
Fe3+/Fe
2H+/H2
Sb3+/Sb
Bi3+/Bi
Cu2+/Cu
Cu+/Cu
Hg22+/2Hg
Ag+/Ag
Hg2+/Hg
Pt2+/Pt
Au3+/Au
Au+/Au
Eo, В
-0,403
-0,277
-0,25
-0,136
-0,127
-0,037
-0,000
+0,20
+0,215
+0,34
+0,52
+0,79
+0,80
+0,85
+1,19
+1,50
+1,70
9
10.
Защита от коррозии:Изоляция металла от коррозийной среды.
Электрохимическая защита.
Изменение свойств коррозийной среды
(изменение состава среды).
Изменение свойств металла.
10
11.
ПокрытияА) Неметаллические (лаки, краски)
Б) Химические (оксидирование,
фосфатирование)
В) Металлические
Вороненая
(Zn, Cu, Cr, Ni, Аu)
сталь
Золочение
Хромирование
Цинкование
11
12.
1213.
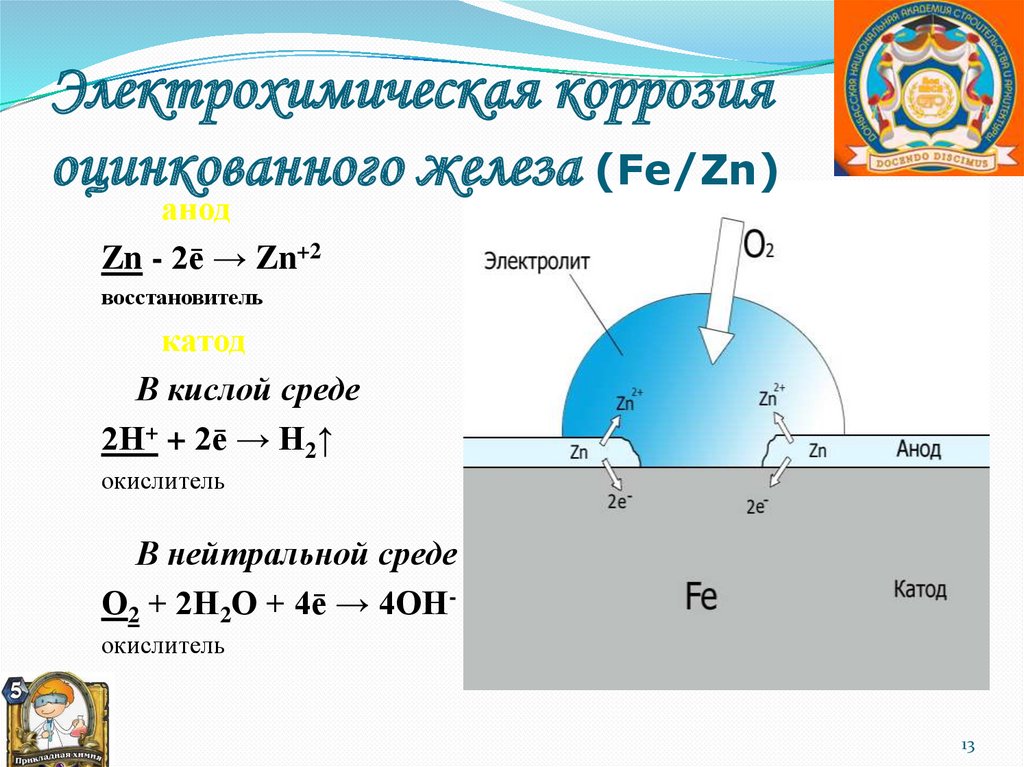
Электрохимическая коррозияоцинкованного железа (Fe/Zn)
анод
Zn - 2ē → Zn+2
восстановитель
катод
В кислой среде
2Н+ + 2ē → Н2↑
окислитель
В нейтральной среде
О2 + 2Н2О + 4ē → 4ОНокислитель
13
14.
Электрохимическая коррозиялуженого железа (Fe/Sn)
Почему при изготовлении консервных банок
их покрывают оловом?
14
15.
Способы защиты откоррозии.
Одним из наиболее распространенных способов
защиты металлов от коррозии является нанесение на
их поверхность защитных пленок: лака, краски, эмали.
15
16.
Широко распространенным способомзащиты металлов от коррозии является
покрытие их слоем других металлов.
Покрывающие металлы сами
корродируют с малой скоростью, так как
покрываются плотной оксидной пленкой.
Производят покрытие цинком, никелем,
хромом и др.
16
17.
Покрытие другимиметаллами.
17
18.
В повседневной жизни человек чаще всего встречаетсяс покрытиями железа цинком и оловом. Листовое
железо, покрытое цинком, называют оцинкованным
железом, а покрытое оловом – белой жестью. Первое в
больших количествах идет на кровли домов, а из
второго изготавливают консервные банки.
18
19.
Способы защиты от коррозии.Изменение состава
среды. Для замедления
коррозии вводятся
ингибиторы. Это
вещества, которые
замедляют скорость
реакции.
Создание сплавов с
антикоррозионными
свойствами. Для этого в
основной металл
добавляют до 12%
хрома, никеля, кобальта
или меди.
19
20.
Способы защиты от коррозии.Применение ингибиторов – один из эффективных
способов борьбы с коррозией металлов в различных
агрессивных средах (в атмосферных, в морской воде, в
охлаждающих жидкостях и солевых растворах, в
окислительных условиях и т.д.). Ингибиторы – это
вещества, способные в малых количествах замедлять
протекание химических процессов или останавливать их.
Название ингибитор происходит от лат. inhibere, что
означает сдерживать, останавливать. Известно, что
дамасские мастера для снятия окалины и ржавчины
пользовались растворами серной кислоты с добавками
пивных дрожжей, муки, крахмала. Эти примеси были
одними из первых ингибиторов. Они не позволяли кислоте
действовать на оружейный металл, в результате чего
растворялись лишь окалина и ржавчина.
20
21.
Электрозащита.1. Протекторная защита.
К основной конструкции
прикрепляются заклёпки
или пластины из более
активного металла,
которые и подвергаются
разрушению. Такую
защиту используют в
подводных и подземных
сооружениях.
21
22.
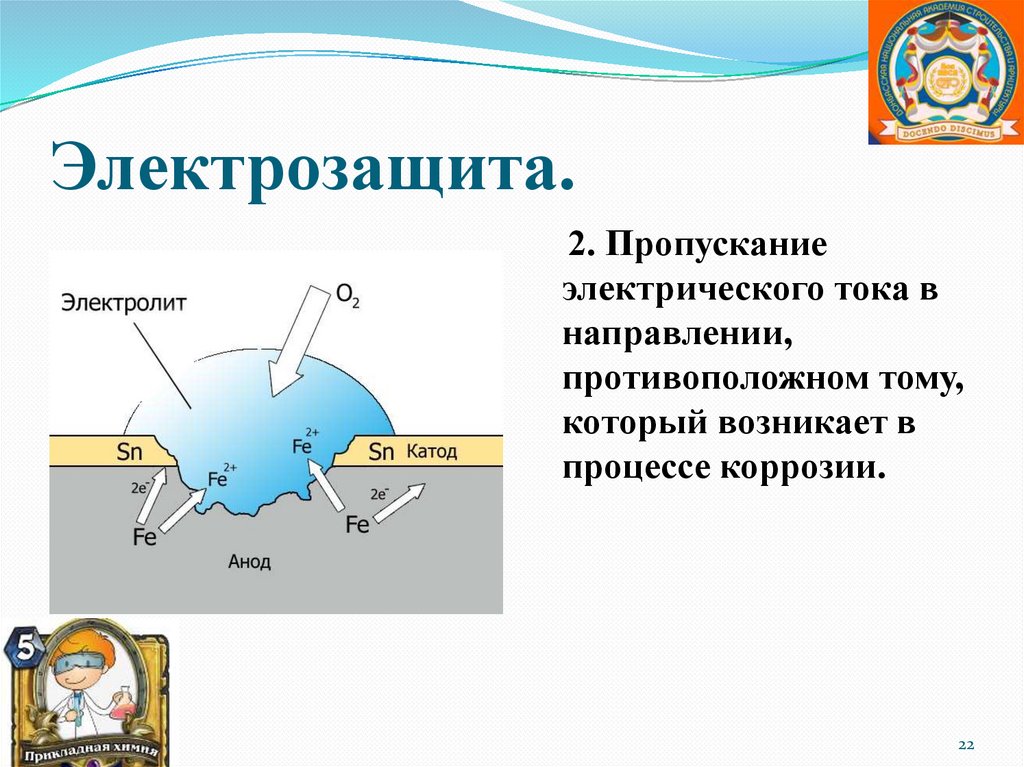
Электрозащита.2. Пропускание
электрического тока в
направлении,
противоположном тому,
который возникает в
процессе коррозии.
22



















 Химия
Химия








